
- Автор Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Последно модифициран 2025-01-22 16:56.
Хлорът изотоп с 18 неутрона има изобилие от 0,7577 и масово число от 35 amu. За да изчислите средно аритметично атомна маса, умножете фракцията по масовото число за всеки изотоп , след което ги добавете заедно.
По същия начин, каква е средната претеглена стойност на всички изотопи на даден елемент?
Използвайки масите от различни изотопи и колко изобилна всяка изотоп е, можем да намерим средно аритметично маса на атомите на an елемент . Атомната маса на an елемент е средно претеглена масата на атомите в естествено срещаща се проба от елемент . Атомната маса обикновено се отчита в единици за атомна маса.
какво има маса от 1 amu? Единицата за атомна маса (символизирана AMU или amu) се определя като точно 1/12 масата на атом въглерод-12. Въглеродният-12 (С-12) атом има шест протони и шест неутрони в нейното ядро. В неточни термини, един AMU е средната стойност на протон масата за почивка и неутрон маса за почивка.
Второ, как се изчислява процентното изобилие, използвайки атомна маса?
Променете всеки процент изобилие в десетична форма, като се раздели на 100. Умножете тази стойност по атомна маса на този изотоп. Добавете заедно за всеки изотоп, за да получите средната стойност атомна маса.
Каква е разликата между атомната маса и атомното тегло?
Атомна маса (ма) е маса на атом . Сингъл атом има определен брой протони и неутрони, така че маса е недвусмислено (няма да се промени) и е сумата от броя на протоните и неутроните в атома . Атомно тегло е средно претеглена стойност на маса от всички атоми на елемент, въз основа на изобилието от изотопи.
Препоръчано:
Как намирате точната стойност на cos 7pi?

ВИДЕО Също така попитах, как намирате точната стойност на детско легло 7pi 6? Детска кошара 7Pi / 6 Radians The детско креватче на 7pi / 6 радиани е √3, същото като детско креватче на 7pi / 6 радиани в градуси. Да се промени 7pi / 6 радиани в градуси се умножават 7pi / 6 на 180° / = 210°.
Как намирате липсващото число, когато имате средна стойност?

Средната стойност на набор от числа е средната стойност на тези числа. Можете да намерите средното, като добавите набора от числа и разделите на колко числа са дадени. Ако ви бъде дадена средната стойност и ви бъде поискано да намерите липсващо число от набора, използвайте просто уравнение
Как намирате стандартното отклонение и средната стойност в Excel?
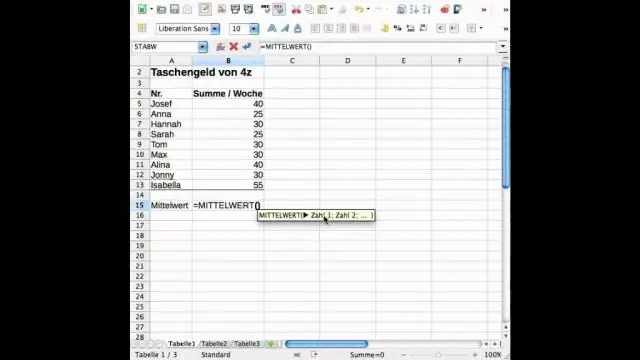
Стандартното отклонение е мярка за това колко дисперсия има в набор от числа в сравнение със средната стойност (средната) на числата. За да изчислите стандартното отклонение в Excel, можете да използвате една от двете основни функции, в зависимост от набора от данни. Ако данните представляват цялата популация, можете да използвате STDEV. Pфункция
Как намирате средната стойност на графика?
За да намерите средната стойност, добавете числата и разделете сумата на броя на събираемите
Как намирате очакваната стойност на средната стойност на извадката?

Очакваната стойност на средната стойност на извадката е средната стойност на популацията, а SE на средната стойност на извадката е SD на популацията, разделена на корен квадратен от размера на извадката
